Resumen: El acné es una afección cutánea inflamatoria altamente prevalente que involucra orzuelos sebáceos. A pesar de que claramente se desarrolla a partir de una interacción de múltiples factores, la causa exacta del acné sigue siendo difícil de alcanzar. Cada vez más se cree que la interacción entre los microbios de la piel y la inmunidad del huésped juega un papel importante en esta enfermedad, con una composición microbiana perturbada y actividad encontrada en pacientes con acné. la Cutibacterium acnes comúnmente se encuentra en áreas ricas en sebo y se ha pensado durante mucho tiempo que su proliferación contribuye a la enfermedad. Sin embargo, la información proporcionada por la secuenciación metagenómica avanzada ha indicado que la microbiota cutánea en pacientes con acné y en individuos sin acné difieren en el virulento específico nivel de linaje.
El acné también tiene estrechas conexiones con el tracto gastrointestinal y muchos argumentan que la microbiota intestinal podría estar involucrada en el proceso patógeno del acné. Con respecto a las emociones del estrés (por ejemplo, depresión y ansiedad), se ha planteado la hipótesis de agravar el acné al alterar la microbiota intestinal y producir un aumento de la permeabilidad intestinal, contribuyendo potencialmente a la inflamación de la piel.
A lo largo de los años, un conjunto de investigaciones en expansión ha puesto de relieve la presencia de un eje entre intestino-cerebro-piel que conecta los microbios intestinales, los probióticos orales y la dieta, actualmente un área de intenso escrutinio, para severidad del acné. Esta revisión se concentra en la piel y los microbios intestinales en el acné, el papel que el eje intestino-cerebro-piel juega en la inmunobiología del acné, y los nuevos emergentes basados en terapias de microbioma que se pueden aplicar para tratar el acné.
Introducción
El término “microbioma” abarca una amplia gama de microorganismos, incluidas bacterias, virus y hongos, sus genes y metabolitos, y el medio que los rodea. La palabra “microbiota” describe el grupo de microorganismos comensales, simbióticos y patógenos encontrados en un entorno fijo. El número de células microbianas que colonizan el cuerpo humano es sorprendente, siendo 10 veces el número de células humanas. Aparte del número, los investigadores están empezando a apreciar que los microbios autóctonos de la piel y el intestino son vitales para el sistema inmunológico, hormonal y metabólico.
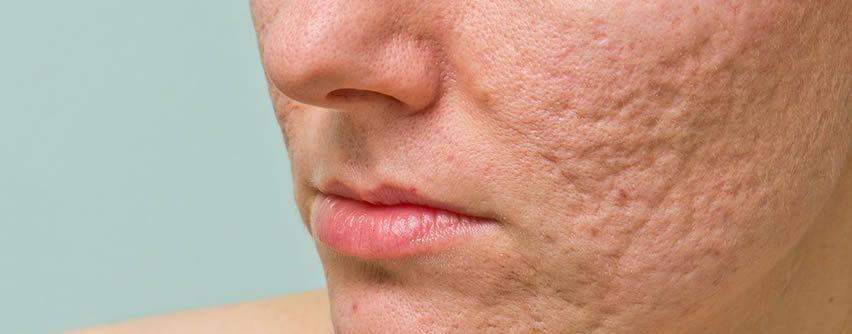
El acné es una afección inflamatoria que afecta a la unidad pilosebácea y que afecta hasta al 90% de los adolescentes. Las formas graves de acné pueden causar desfiguración y cicatrices, lo que da como resultado una baja autoestima, dificultades en la interacción social y angustia psicológica. Se cree que los mediadores de la piel y la queratinización folicular de los conductos pilosebáceos contribuyen al desarrollo del acné. La colonización por Cutibacterium acnes también se reconoce en pacientes con acné, pero su papel no está claro porque es omnipresente en las áreas de piel sana desde la pubertad en adelante. Como parte del creciente interés en el microbioma humano, los hallazgos del estudio han comenzado a aclarar cómo los microorganismos de la piel participan en la salud y la enfermedad (acné).
Los datos emergentes sugieren que los factores dietéticos (es decir, la dieta occidental) pueden influir en el desarrollo del acné. Una dieta de patrón occidental típica que incluye alimentos con una mezcla compleja de grasas (es decir, carne roja), alto índice glucémico y los lácteos, pueden agravar el acné al aumentar los niveles del factor de crecimiento similar a la insulina. La dieta también da forma a la microbiota intestinal. Una gran cantidad de evidencia indica que una dieta occidental baja en fibra y alta en grasas provoca cambios fundamentales en la microbiota intestinal, produciendo enfermedades de la piel metabólicas e inflamatorias. En esta revisión, se discuten las interacciones huésped-microbio en el acné para aclarar la comprensión de la enfermedad y y permitir mejores tratamientos.
Microbiota cutánea (descripción general)
La piel humana, que cubre un área de 2 m2 en adultos, es el órgano más grande del cuerpo y proporciona la primera línea de defensa frente a agentes externos. La piel funciona como una barrera tanto física como inmunológica, realizando una amplia gama de funciones inmunes innatas y adaptativas. Los microbios cutáneos residentes
estabilizan la barrera del huésped combatiendo los patógenos, interactuando con las células inmunes en la piel y modificando la inmunidad del huésped. Por tanto, la microbiota cutánea es una parte esencial de la salud humana, y se cree que la disbiosis causa o agrava enfermedades de la piel. Avances en la tecnología de secuenciación, como la secuenciación del gen del ARN ribosómico 16S (ARNr 16S), han proporcionado una gran comprensión del microbioma humano.
Muestreo de microbioma cutáneo
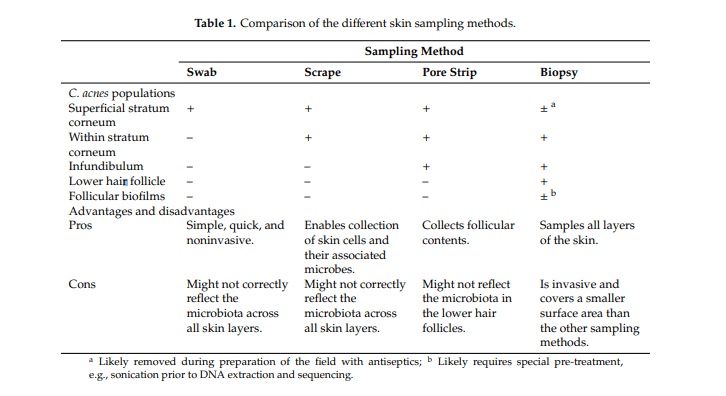
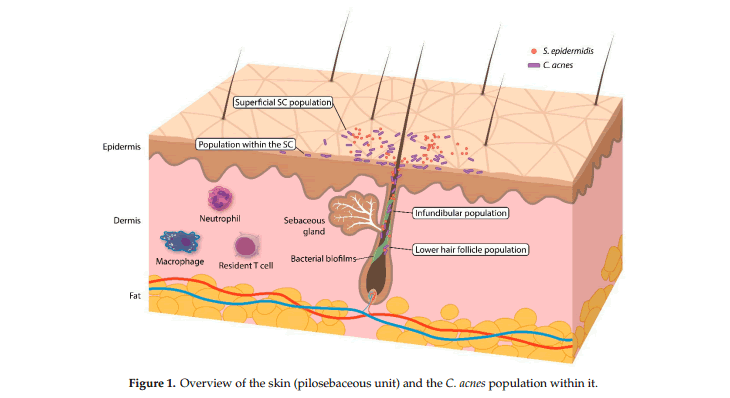
Adquirir una muestra precisa y representativa es un gran desafío en el estudio del microbioma de la piel. En estudios anteriores se han documentado popularmente cuatro métodos de muestreo: frotis de piel, raspado, extracción de poros y biopsias por punción (Tabla 1). Entre las diferentes metodologías, hisopado es el más práctico, simple, rápido y no invasivo. Sin embargo, el hisopado puede no ser correcto reflejando la microbiota en todas las capas de la piel. El raspado de la piel ofrece los beneficios de recolectar células de la piel y sus microbios asociados. Decapado de poros con cinta adhesiva flexible o pegamento de cianoacrilato recolecta contenido folicular y puede ser útil en estudios de acné. Una biopsia por punción muestra las tres capas de la piel y podría representar mejor la microbiota cutánea (Figura 1).
Análisis del microbioma cutáneo
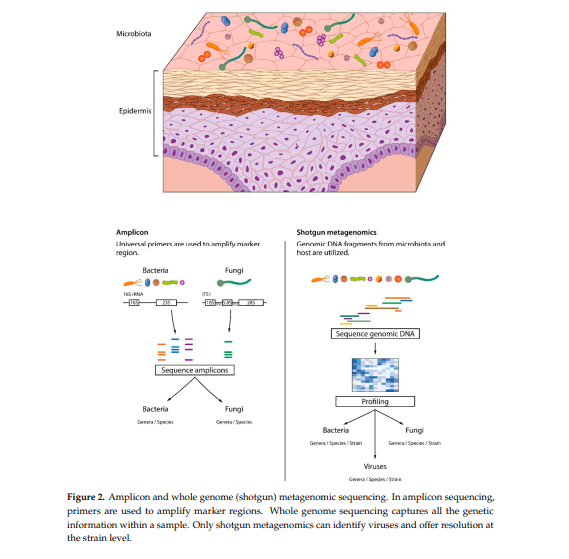
Los primeros estudios de la microbiota de la piel utilizaron métodos basados en cultivos para la identificación bacteriana y caracterización. Las comunidades microbianas descritas por enfoques basados en la cultura son insuficientes, con menos del 1% de las especies bacterianas en cultivo. Además, esos estudios han centrado en estafilococos coagulasa negativos y Propionibacterium para reducir el tiempo de trabajo, haciendo sus resultados aún más incompletos. Para superar esas limitaciones, se han introducido enfoques basados en ADN (Figura 2). Entre ellos, secuenciación de amplicones de rDNA 16S ha sido un gran avance en la identificación bacteriana, permitiendo la diferenciación bacteriana en el nivel de especie.
Microbiota de la piel humana (piel sana)
Como habitante principal de la piel, las bacterias son las partes mejor estudiadas de la microbiota cutánea. La mayoría de las bacterias comensales de la piel se clasifican en los siguientes cuatro filos: Actinobacterias (es decir, Corynebacterineae, Propionibacterineae), Proteobacteria, Firmicutes (es decir, Staphylococcaceae) y Bacteroidetes. La composición bacteriana difiere de persona a persona y varía según el sitio del cuerpo. Factores ambientales como el uso de jabones, cosméticos, antibióticos, ocupación, la temperatura, la humedad y la exposición a los rayos UV también influyen en la colonización microbiana.
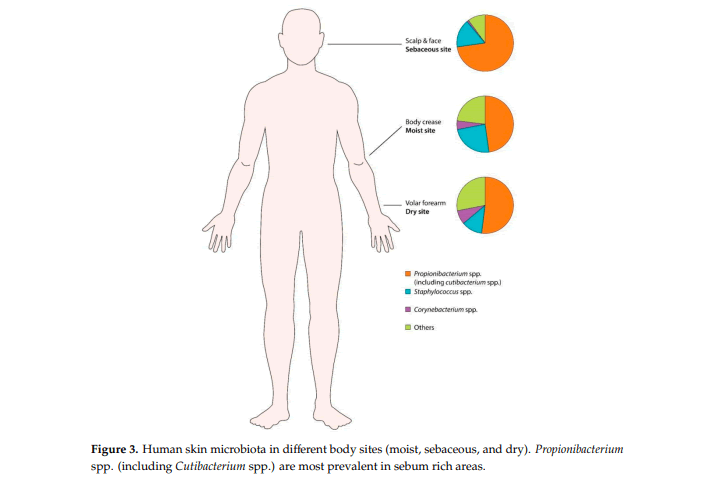
Los sitios corporales se dividen en tres categorías: húmedos, sebáceos y secos (Figura 3). Los microbios se encuentran preferentemente en áreas húmedas (es decir, axilas, área inguinal, planta del pie, fosa poplítea) son Staphylococcus y especies de Corynebacterium. Sitios sebáceos como la frente, área retroauricular y espalda, muestran la diversidad bacteriana más baja, lo que indica que solo un pequeño subconjunto de organismos puede tolerar esta condición. Las especies de Propionibacterium (incluyendo Cutibacterium) son los principales aislamientos de las áreas sebáceas, porque pueden sobrevivir en una condición anaeróbica y rica en lípidos. Áreas secas de la piel (es decir, antebrazo) tienen la comunidad microbiana más diversa, llevando una mezcla de los cuatro filos principales.
La composición microbiana de la piel cambia con la edad. En los recién nacidos, la microbiota de la piel en gran parte depende de la vía de parto (vaginal o cesárea), y en la infancia, Firmicutes se convierte en dominante. La microbiota de las áreas sebáceas (es decir, la cara) toma forma durante la pubertad como hormonas y estos cambios activan las glándulas sebáceas. En particular, la variación interpersonal es mayor que los cambios dentro de la misma persona a lo largo del tiempo. El género también es un factor importante del huésped que influye en las bacterias, la composición y diversidad. Las superficies de las manos y los antebrazos de las mujeres están colonizadas por un conjunto más diverso de microbios que los hombres, mientras que los hombres portan más Malassezia que las mujeres. Tal diferencia de género podría explicarse parcialmente por hábitos de comportamiento, como el uso de maquillaje.
Microbiota cutánea y acné
Desde su primera observación en lesiones de acné por Unna (1896) y su aislamiento por Sabouraud (1897), C. acnes se ha considerado el patógeno más probable del acné. C. acnes originalmente se llamaba Bacillus acnes, y fue posteriormente renombrado Corynebacterium acnes porque es morfológicamente similar a Corynebacterium. Fue etiquetado como P. acnes en la década de 1940 debido a su capacidad para producir ácido propiónico. En 2016, una novela género, Cutibacterium se propuso para un subconjunto de Propionibacterium (Propionibacterium cutáneo), y así P. acnes ahora se llama Cutibacterium acnes (C. acnes). C. acnes es el principal ocupante de la unidad pilosebácea y representa hasta el 90% de la microbiota en sitios ricos en sebo como el cuero cabelludo, la cara, el pecho y la espalda. El cuero cabelludo y la cara llevan la mayor densidad de C. acnes, seguida de las extremidades superiores y el tronco, con las extremidades inferiores mostrando la menor C. acnes. La abundancia de C. acnes también cambia con la edad. C. acnes es escasa en la infancia, aumenta gradualmente desde la pubertad hasta la edad adulta y luego disminuye después de los 50 años.
Estudios metagenómicos recientes han arrojado nueva luz sobre las diferencias de nivel de cepa de C. acnes en salud y enfermedad (acné). Tomida y col. compararon las secuencias de ADN completas de cepas de C. acnes para encontrar que el sector genómico no central de las cepas de C. acnes relacionadas con el acné tiene genes de virulencia adicionales en comparación con las cepas saludables. Johnson y col. identificó que las cepas relacionadas con el acné generan más porfirina, una sustancia que genera especies reactivas de oxígeno (ROS) y puede provocar inflamación en queratinocitos. Además, se demostró que las cepas de C. acnes responden de manera diferente a la vitamina B12.
Cutibacterium acnes en el acné
C. acnes es un bastón pleomórfico grampositivo aerotolerante, anaeróbico que pertenece a la Filo de actinobacterias. Se han propuesto varios mecanismos por los cuales C. acnes agrava el acné, incluido el aumento de la lipogénesis, la formación de comedones y la inflamación del huésped (Figura 4).
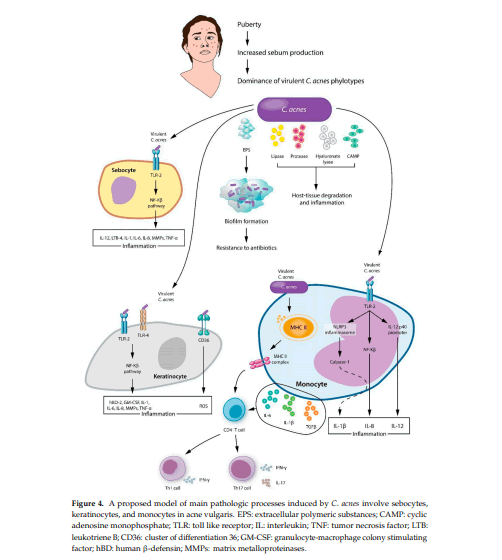
Las cepas de C. acnes que son altamente virulentas y resistentes a los antibióticos (es decir, RT4, 5, 10), son dominantes en la piel de los pacientes con acné. Factores de virulencia como lipasa, proteasa, hialuronato liasa, endoglucoceramidasa, neuraminidasa y factor de Christie-Atkins-Munch-Petersen (CAMP) causan degradación e inflamación del tejido del huésped. La quimio-lipasa atrae neutrófilos e hidroliza triglicéridos del sebo a ácidos grasos libres, induciendo inflamación e hiperqueratosis. La proteasa, hialuronato liasa, endoglucoceramidasa y neuraminidasa tienen propiedades degradantes y ayudan a la invasión de C. acnes al descomponer los constituyentes de la matriz extracelular. Como el extracelular la matriz se resuelve, las células inflamatorias (es decir, neutrófilos, monocitos, células dendríticas) invaden el folículo, provocando la efusión de bacterias, queratina y sebo a la dermis, lo que provoca granuloma de cuerpo extraño y cicatrización. Las propiedades estructurales y la fisiología de las bacterias del biofilm confieren resistencia a los agentes antibacterianos y células inflamatorias del huésped.
Otra microbiota asociada al acné
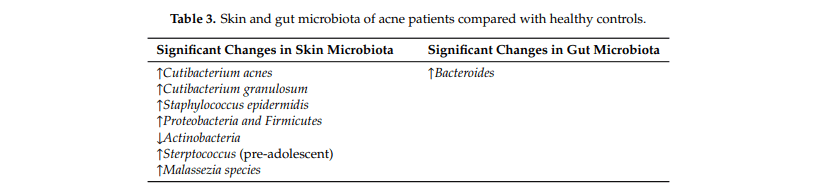
La piel humana está colonizada por una amplia variedad de microbios, que funcionan para mantener la salud de la piel o agravar la enfermedad. Aunque C. acnes es mejor conocido por su conexión con el acné, se ha especulado que otras bacterias también podrían contribuir (indirectamente) al proceso inflamatorio (Tabla 3).
Tratamiento del acné y microbios cutáneos
Debido a que el acné es una afección inflamatoria multifactorial de la piel, algunas opciones de tratamiento son disponibles, incluidos antibióticos tópicos y orales, retinoides y terapia fotodinámica. El acné no es una infección cutánea típica, pero los antibióticos han desempeñado un papel fundamental en el tratamiento del acné durante más de 40 años. Los antibióticos tópicos suprimen C. acnes y actúan como un agente antiinflamatorio. Los antibióticos orales son mejor para el acné de moderado a severo, especialmente para aquellos que no responden o no toleran los agentes tópicos. Los tratamientos alternativos para el acné incluyen luz azul, fototerapia ultravioleta (UV) y fotodinámica.
Los antibióticos y la microbiota cutánea del acné
Pocos estudios han examinado los efectos de los antibióticos en la microbiota de la piel en el acné. De acuerdo a investigación basada en cultivos, los antibióticos de tetraciclina causan una disminución en la abundancia de Cutibacterium en piel de pacientes con acné.
Resistencia a los antibióticos en la microbiota de la piel con acné
Los antibióticos tópicos y orales han sido el centro del tratamiento del acné durante mucho tiempo. La resistencia de C. acnes a los antibióticos ha aumentado a lo largo de los años y se ha convertido en un problema mundial en los pacientes con acné con tasas más altas de resistencia a la clindamicina (lincosamida) (36-90%) y eritromicina
(macrólido) (21 a 98%) que a las tetraciclinas (4 a 16%). Esto está en consonancia con el hecho de que los macrólidos y la clindamicina son los más utilizados. El grado de resistencia a los antibióticos varía entre las diferentes cepas de C. acnes. El uso de clindamicina y macrólidos en el acné no solo hace que C. acnes sea resistente a los antibióticos pero también conduce a una mayor resistencia a los medicamentos entre otras bacterias de la piel.
La microbiota cutánea como biomarcador para el desarrollo de fármacos para el acné
Varios estudios han comparado la microbiota cutánea de pacientes con acné e individuos sin acné para encontrar diferencias en las cepas dominantes de C. acnes (las manchas más virulentas se asociaron con el acné). También se sabe que el tratamiento del acné reduce la cantidad de C. acnes en la piel y causa un aumento en la
diversidad de bacterias cutáneas. Dado el vínculo claro entre el acné y C. acnes, la microbiota cutánea podría utilizarse como un biomarcador para el desarrollo de fármacos para el acné y ensayos clínicos.
Microbiota intestinal y piel
La piel y el intestino, ambos órganos muy vascularizados y ricamente inervados con las funciones neuroendocrinas e inmunitarias son algo similares. Curiosamente, la evidencia acumulada sugiere que los dos órganos tienen una conexión bidireccional, y muchos estudios relacionan la salud intestinal con homeostasis y alostasis cutáneas. El intestino contiene una extensa colección de bacterias, hongos, virus y protozoos que supera en número a sus células hospedadoras en 10 veces. Los avances recientes en metagenómica han ampliado nuestra comprensión sobre la microbiota intestinal y su influencia en la salud y las enfermedades humanas. La microbiota intestinal realiza funciones metabólicas e inmunes, desempeñando un papel fundamental en el mantenimiento de la homeostasis fisiológica. La flora intestinal descompone los alimentos y los polisacáridos complejos no digeribles, sintetiza vitaminas esenciales (vitamina K y biotina), y así proporciona beneficios nutricionales al anfitrión. La microbiota intestinal también regula intrincadamente el sistema inmunológico del huésped, lo que hace posible tanto tolerancia a antígenos dietéticos y ambientales y defensa contra patógenos potenciales.
Actualmente, hay pruebas contundentes que indican que los microbios intestinales desempeñan un papel mediador entre la inflamación de la piel y emoción. Aunque aún no se conoce del todo, el mecanismo por el cual la microbiota intestinal influye en homeostasis de la piel parece provenir de su efecto modulador sobre la inmunidad sistémica. Además, la evidencia sugiere que la flora intestinal puede afectar la piel de manera más directa, al transportar la microbiota intestinal a la piel. Cuando se rompe la barrera intestinal, la microbiota intestinal y sus metabolitos ingresan rápidamente al torrente sanguíneo, se acumulan en la piel y alteran el equilibrio de la piel.
Microbiota intestinal y acné
Se cree que la flora intestinal influye en el acné, posiblemente al interactuar con el mTOR. Los metabolitos de la microbiota intestinal pueden controlar constitutivamente la expansión celular, al metabolismo de la grasa y otras funciones metabólicas a través de la vía mTOR. La vía mTOR por sí misma también puede afectar la microbiota intestinal al controlar la barrera intestinal. En casos de intestino disbiosis y una barrera intestinal alterada, se puede formar un circuito de retroalimentación positiva, que puede amplificar el metabolismo y la inflamación del huésped. Considerando el posible papel de mTORC1 en el acné, la interacción entre mTOR y la microbiota intestinal puede servir como un mecanismo por lo que la flora intestinal agrava el acné. La conexión entre el acné y la disfunción gastrointestinal puede originarse en el cerebro. Apoyando esta hipótesis está el agravamiento del acné inducido por el estrés. Los estudios en humanos han demostrado que el estrés afecta la microflora intestinal normal, sobre todo Lactobacillus y especies de Bifidobacterium.
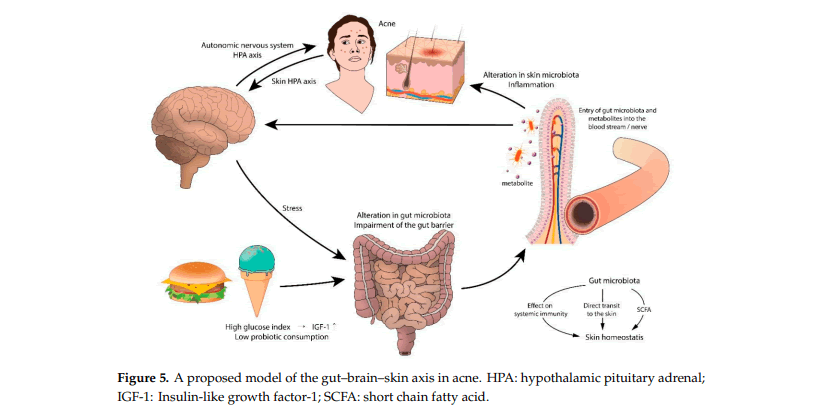
Microbiota intestinal en el acné
El primer estudio de este tipo fue realizado en 1955 y comparó la presencia de bacterias potencialmente patógenas en 10 pacientes con acné con individuos sin acné. Es de destacar que las especies de Bacteroides, que aumentan en condiciones de estrés, se aislaron con frecuencia de pacientes con acné. Un estudio ruso informó que las personas con acné muestran una flora intestinal marcadamente diferente en comparación con los controles sin acné. En un estudio de Deng et al., los pacientes con acné mostraron una menor diversidad de microbiota intestinal y una mayor relación de Bacteroidetes a Firmicutes, que es un enterotipo de la dieta occidental. Además, Yan et al. encontró una disminución de Lactobacillus, Bifidobacterium, Butyricicoccus, Coprobacillus y Allobaculum en el acné en pacientes en comparación con los controles, lo que proporciona una nueva comprensión del vínculo entre el acné y la alteración de la flora intestinal. Lactobacillus y Bifidobacterium son especies probióticas comunes que equilibran la microbiota intestinal fermentando oligosacáridos no absorbidos en el intestino superior. Ellos también fortalecen la barrera intestinal disminuyendo la permeabilidad y mejorando la resistencia epitelial de el intestino. Además, Bifidobacterium y Lactobacillus estimulan la producción de CD4 + Foxp3 + T células (células T reguladoras) y células dendríticas reguladoras, que suprimen la respuesta de las células T auxiliares y de las células B y producción de citocinas. Butyricicoccus genera butirato, que proporciona energía a las células y previene el daño y la inflamación de la barrera mucosa.
Deben realizarse más estudios para identificar la flora enteral de los pacientes con acné y encontrar cambios en la microbiota intestinal después de la terapia del acné (es decir, antibióticos orales e isotretinoína).
Probióticos y acné
La creciente evidencia indica que los probióticos modifican los factores fisiopatológicos que contribuyen al acné, mejorando potencialmente el cumplimiento del paciente. Los probióticos inhiben directamente C. acnes con proteínas antimicrobianas.

Fuente: Journal of Clinical Medicine. The Catholic University of Korea.